Energieträger Wasserstoff
Wasserstoff als Energieträger der Zukunft
Wasserstoff ist einer der großen Hoffnungsträger für eine klimaneutrale Energiewende: Er ist leicht, kann theoretisch in der vorhandenen Gasinfrastruktur transportiert und gespeichert werden, ist sowohl als Zwischenmedium zur Energieumwandlung als auch als Endprodukt einsetzbar und setzt je nach Art weniger bis gar keine Emissionen frei. In der Natur kommt er zum Beispiel gebunden mit Sauerstoff (O2) als Wasser (H2O) oder auch in Form von Kohlenwasserstoffen in Methan (CH4) oder Erdöl vor.
Die Farben des Wasserstoffs
Obwohl auf den ersten Blick farblos, ist Wasserstoff in Wirklichkeit ein farbenreiches Element, dessen 'Farbe' durch die genutzten Energieträger bei der Erzeugung bestimmt wird. Erhalten Sie in kompakter Form wissenswerte Informationen über die verschiedenen Farben des Wasserstoffs und deren Zusammenhang mit spezifischen Produktionsmethoden.
Elektrolyse – Wie aus Wasser und Strom grüner Wasserstoff wird
Wasserstoff kommt in der Natur nur als gebundener Träger vor. Entsprechend muss er unter Nutzung von Primärenergie abgespalten werden. Derzeit werden über 90 % des Wasserstoffs über Steamreforming, also unter Einsatz von Erdgas, erzeugt. Daneben gibt es bereits erste Verfahren, die Wasserstoff aus Biomasse mit Hilfe der (hydrothermalen) Vergasung erzeugen. Angesichts einer zunehmenden, politisch geforderten Produktion von Erneuerbaren Strom, z. B. mittels Windkraft, steht die (Wasser-)Elektrolyse als attraktive Erzeugungsmöglichkeit für Wasserstoff im Fokus einer Vielzahl von Überlegungen.
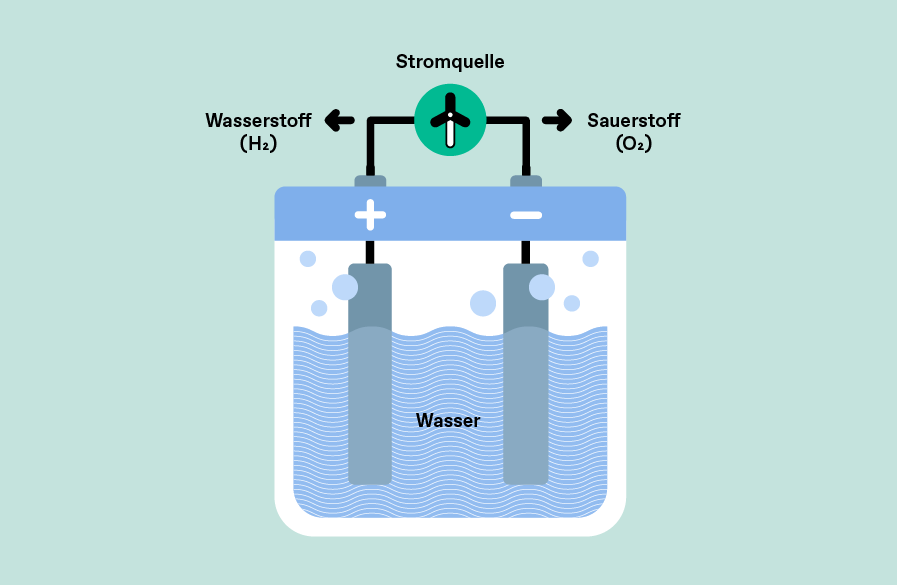
Bei der Elektrolyse wird in einer sog. Elektrolysezelle Wasser (H2O) mithilfe einer elektrischen Stromquelle in seine Bestandteile Wasserstoff (H2) und Sauerstoff (O2) aufgespalten. Dazu werden zwei Elektroden unter Strom gesetzt: An der Anode findet die Oxidation statt, bei der Sauerstoff erzeugt wird; an der Kathode findet die Reduktion statt, bei der Wasserstoff erzeugt wird. Der erzeugte Sauerstoff kann entweichen, während der Wasserstoff gesammelt und (weiter-)genutzt werden kann. Durch den Einsatz Erneuerbarer Energien aus Solar oder Wind wird das Verfahren nachhaltig und es entsteht grüner Wasserstoff.
Elektrolyse-Arten
Bei der Elektrolyse von Wasser zur Herstellung von Wasserstoff können verschiedene Verfahren Anwendung finden:
Alkalische Elektrolyse (AEL)
Die AEL ist die älteste Elektrolyse-Technologie. Hier sind die zwei, meist nickelbasierten Elektroden durch ein poröses Diaphragma voneinander getrennt. Wird Spannung angelegt, entstehen an der Kathode aus Wasser (H2O) unter Elektronenaufnahme Hydroxidionen (OH-) und Wasserstoff (H2). Die Hydroxid-Ionen bewegen sich aufgrund ihrer negativen Ladung durch die Membran in Richtung Anode, wo sie unter Elektrodenabgabe zu Sauerstoff (O2) und Wasser (H2) reagieren. Gleichzeitig ist die Membran gasundurchlässig und verhindert so die Vermischung von Sauerstoff mit dem Wasserstoff.
Die Vorteile der AEL liegen aufgrund der technischen Reife vor allem in den geringen Investitionskosten. Zudem verfügt diese Elektrolyseart über eine Langzeitstabilität der Zelle und verwertet kaum bis keine kritischen Rohstoffe. Besonders nachteilig sind jedoch die mit dem Verfahren einhergehenden hohen technischen Anforderungen und die lange Kaltstartzeit, weswegen schwankende Stromquellen wie Windenergie problematisch sind.
Polymerelektrolytmembran-Elektrolyse (PEM)
Hier wird, wie der Name sagt, eine Polymerelektrolytmembran (PEM) in der Elektrolysezelle verwendet. Diese ermöglicht den Transport der auf der Anodenseite gebildeten Protonen zur Kathodenseite, wo diese diffundieren; und verhindert gleichzeitig das Durchdringen von Gasen. Grüner Wasserstoff wird derzeit vorrangig mittels PEM-Elektrolyse erzeugt.
Die Vorteile der PEM-Elektrolyse liegen in ihrer Effizienz, hohen Leistungsdichte, präzisen Steuerung und Reaktionsgeschwindigkeit. Nachteilig ist jedoch, dass die PEM-Elektrolyse empfindlich gegenüber Verunreinigungen und bestimmten Umgebungsbedingungen reagieren kann, was zu Leistungsverlusten führt. Zudem ist insbesondere der Einsatz von Platin- oder Iridium-Katalysatoren mit hohen Kosten verbunden. Daher liegt derzeit der Fokus auf der Entwicklung alternativer Katalysatoren.
Anionenaustauschmembran-Elektrolyse (AEM)
Die AEM-Elektrolyse basiert auf dem Prinzip der AEL, verwendet jedoch eine Anionenaustauschmembran als Elektrolyt anstelle einer alkalischen Lösung. Die Membran ist für die negativ geladenen Hydroxidionen durchlässig und blockiert wiederum den Durchgang für die positiv geladenen Wasserstoffionen, sodass diese abgetrennt werden.
Dieses Verfahren bietet Vorteile wie geringere Betriebskosten aufgrund des Verzichts auf teure Edelmetallkatalysatoren und die Möglichkeit der Verwendung von nichtalkalischen Elektrolyten. Allerdings befindet sich diese Technologie noch in der Entwicklung und es bestehen Herausforderungen hinsichtlich der Langzeitstabilität der Membranen und der Reaktionseffizienz.
Hochtemperatur (Feststoffoxid)-Elektrolyse / Solid-Oxid-Electrolysis-Cell (SOEC)
Bei der Hochtemperatur-Elektrolyse wird ein keramischer Festkörperelektrolyt, typischerweise Yttrium stabilisiertes Zirkoniumoxid, verwendet. Eine Anionenaustauschmembran trennt die Kathode und Anode voneinander. Die Kathode besteht aus porösen Materialien wie Nickel und einer Metall-Keramik-Verbindung, während die Anode aus einem Perowskit-Kristall besteht. Eine Gasdiffusionsschicht verhindert unerwünschte Reaktionen zwischen den Materialien. Die HT-Elektrolyse wird typischerweise bei 800°C bis 1200°C durchgeführt. Sie eignet sich deshalb besonders gut für Industriestandorte mit vorhandener Hochtemperatur-Abwärme.
Der große Vorteil der HT-Elektrolyse liegt in ihrem niedrigeren Energiebedarf und dem höheren Wirkungsgrad bei steigender Temperatur. Die Mindestspannung, um die Zersetzung von Wasser in Sauerstoff und Wasserstoff zu erreichen, ist bei höheren Temperaturen geringer, was zu einem effizienteren Betrieb führt. Die HT-Elektrolyse befindet sich jedoch noch in der Pilotphase und wurde bislang nicht großindustriell umgesetzt.
Speicherung von Wasserstoff
Die Zukunft ist klar: Eine klimaneutrale und zugleich sichere Energieversorgung. Dafür sind Speicher unabdingbar. Denn in Deutschland kann zwar in den wind- und sonnenreichen Monaten viel erneuerbare Energie erzeugt werden, die größten Gesamtverbrauche liegen aber in den restlichen Monaten, wenn es früh dunkel wird und draußen kalt ist. Speicher für Gase zeigen hier die besten Potenziale, denn nur sie können Energien in größeren Mengen und über längere Zeiträume speichern. So können verschiedene Auslastungen – ob im Tagesverlauf oder jahreszeitenabhängig – gesteuert werden.

Insbesondere Regionen, die durch eine konzentrierte, energieintensive sowie schwer oder gar nicht elektrifizierbare Produktion (wie Stahl- oder Chemieindustrie) gekennzeichnet sind, benötigen zeitnah eine H2-Speicherlösung. So kann zum einen den witterungsbedingten Schwankungen der Stromerzeugung aus Wind und Sonne begegnet, zugleich aber auch eine durchgehende und sichere Verfügbarkeit von Wasserstoff auf der industriellen Abnehmerseite garantiert werden. Für geringfügige lokale Ausgleichprozesse gibt es kleine oberirdische Gasspeicher. Für eine langfristige und ortsunabhängige Energieversorgung bedarf es unterirdische Speicher in Form von Salzkavernen- oder Porenspeicher.
Dafür stehen in Ostdeutschland perspektivisch 5 Gebiete mit Salzkavernen zur Verfügung. Diese eignen sich aufgrund ihrer geologischen Eigenschaften und ihres großen Fassungsvermögens besonders gut für die Speicherung von Wasserstoff. In Rüdersdorf nahe Berlin (EWE) in Brandenburg sowie in Bad Lauchstädt (VGS) in Sachsen-Anhalt entstehen derzeit schon zwei H2-Kavernenspeicher. Letzterer umfasst ein Arbeitsgasvolumen von 50 Mio³, etwa 5.000 Tonnen Wasserstoff. Für Gesamtdeutschland gibt der Interessenverband Gas Infrastructure Europe (GIE) ein Speicherpotenzial von 40 TWh Wasserstoff in Kavernen an. Damit ist es auch möglich, etwaige Wasserstoffimporte zwischenzuspeichern.
Speicherarten
Die Gasspeicherung kann in natürlichen oder künstlichen Hohlräumen unter der Erdoberfläche erfolgen: in Hohlraumspeichern (Kavernen) oder in Porenspeichern.
Salzkavernenspeicher
Salzkavernen sind große künstlich angelegte, zylinderförmige Hohlräume, welche mit Hilfe von Wasser durch gezieltes Ausschwemmen (sog. Solen) von Salzstöcken entstehen. Sie können einen Durchmesser von bis zu 100 Metern, Höhen zwischen 50 und 500 Metern und ein Volumen von bis zu 800.000 Kubikmeter einnehmen. Durch die petrochemischen Eigenschaften des Salzes ist eine zusätzliche Abdichtung der Kaverne nicht nötig. Bei Tiefen von 800 bis 1.500 Metern können maximale Drücke von etwa 200 bar erreicht werden. Diese Eigenschaften ermöglichen neben der Speicherung großer Gasvolumina auch eine schnelle Ein- und Ausspeicherung. Daher eignen sich diese Speicher insbesondere zur Bewältigung kurzfristiger, hoher Bedarfsschwankungen. Da Wasserstoff nicht mit dem Salzgestein reagiert, sind Salzkavernen besonders gut für dessen Speicherung geeignet. Diese Speichertypen sind überwiegend im Nordwesten Deutschlands und in Mitteldeutschland vorhanden.
Derzeitige Berechnungen gehen davon aus, dass der Umbau eines Kavernenspeichers zur H2-Speicherung nur 30 Prozent der Neubaukosten eines Kavernenspeichers und nur fünf statt zehn Jahren Vorlaufzeit bis zur Nutzung benötigt. Auf alle bestehenden Kavernenspeicher in Deutschland hochgerechnet, würde der Investitionsbedarf für Umrüstungen zur Speicherung von Wasserstoff von etwa 6,5 Mrd. Euro bis 2030 bzw. 30 Mrd. Euro bis 2050 erfordern. Zum Vergleich: Die gleiche Energiemenge in Form eines Batteriespeichers zu speichern, verursacht 100-mal mehr Kosten.
Porenspeicher
Bei Porenspeichern handelt es sich um natürliche Sandsteinformationen mit gasundurchlässigen Deckformationen, welche große Gasvolumina aufnehmen können. Neben wasserführenden Gesteinsformationen werden auch leergeförderte Erdöl- und Erdgaslagerstätten genutzt. Aufgrund der Löslichkeit von Wasserstoff-Gas-Gemischen im Wasser und den geochemischen Wechselwirkungen mit dem Gestein sind diese Speicher jedoch derzeit nicht für die Speicherung von Wasserstoff geeignet. Dieser Speichertyp ist vor allem im Süden Deutschlands vorhanden.